Oksidasyon ve redüksiyon, kayaçların ayrışmasında önemli rol oynayan kimyasal reaksiyonlar türüdür. Bu reaksiyonlar, minerallerin kimyasal bileşimini değiştirerek ufalanma ve çözünme gibi ayrışma süreçlerini tetikler. Kayaçların kimyasal yolla ayrışmasına neden olan oksidasyon ve redüksiyon tanımlarını ve detaylı bilgileri şu şekilde açıklayabiliriz;
Oksidasyon
Kayaçların ayrışmasında önemli bir rol oynayan bir kimyasal reaksiyon türüdür. Bir elementin veya bileşiğin oksijenle reaksiyona girmesi sonucu elektron kaybetmesi olayıdır. Kayaçlarda oksidasyon, genellikle demir, magnezyum ve kalsiyum gibi elementlerin oksijenle reaksiyona girmesiyle gerçekleşir. Bu reaksiyonlar sonucunda mineral oksitleri ve hidroksitleri oluşur. Çözünen madde ile element halindeki oksijenin birleşmesi sonucu meydana gelir. Örnek olarak; Atmosferdeki kimyasal olarak aktif oksijen Fe ile reaksiyona girer ve demir okside olur (paslanır).
4 Fe + 3 O2 = 2 Fe2O3
Demir Oksijen Hematit
Oksidasyonun Kayaç Ayrışmasına Etkileri
Oksidasyon, kayaçların ayrışmasına farklı mekanizmalar yoluyla katkıda bulunur:
1. Ufalanma
- Oksidasyon sonucu oluşan mineral oksitleri ve hidroksitleri, genellikle suda çözünür. Bu çözünürlük, kayaçların ufalanmasına ve çözünmesine yol açar. Örneğin, demir içeren minerallerin oksitlenmesi sonucu hematit ve limonit gibi mineraller oluşur. Bu mineraller suda çözünür ve kayaçların ufalanmasına neden olur.
- Oksidasyon, kayaçlarda çatlak ve boşluk oluşumuna da yol açabilir. Bu çatlaklar ve boşluklar, su ve diğer kimyasalların kayaçlara nüfuz etmesine ve daha fazla ayrışmaya neden olur.
2. Kimyasal Bileşimde Değişiklik
- Oksidasyon, kayaçların kimyasal bileşimini önemli ölçüde değiştirebilir. Örneğin, demir içeren minerallerin oksitlenmesi, kayaçların demir içeriğini azaltabilir.
- Kimyasal bileşimdeki değişiklikler, kayaçların minerallerinin stabilitesini de etkileyebilir. Bu durum, minerallerin ayrışmasına ve yeni minerallerin oluşmasına yol açabilir.
Oksidasyonun Hızını Etkileyen Faktörler
Oksidasyon reaksiyonlarının hızı, bir dizi faktöre bağlıdır:
- Sıcaklık: Sıcaklık arttıkça reaksiyonların hızı da artar.
- Nem: Nem arttıkça oksidasyon reaksiyonlarının hızı da artar.
- Minerallerin bileşimi: Farklı mineraller farklı oksidasyon hızlarına sahiptir. Örneğin, demir içeren mineraller, diğer minerallere göre daha hızlı oksitlenir.
- Organik madde: Organik madde, oksidasyon reaksiyonlarını hızlandırabilir.
- Asitlik: Asidik ortamlar, oksidasyon reaksiyonlarını hızlandırır.
Oksidasyonun Kayaç Ayrışmasına Örnekleri
- Demir içeren minerallerin paslanması: Demir içeren minerallerin oksijenle reaksiyona girmesi sonucu pas oluşur. Pas, kayaçların ufalanmasına ve çözünmesine neden olur.
- Karbonat kayalarının çözünmesi: Yağmur suyundaki karbondioksit, karbonat kayaları ile reaksiyona girerek onları çözer. Bu çözünme, karstik mağaralar ve diğer jeolojik oluşumların oluşmasına neden olur.
- Kireçtaşlarının çözünmesi: Kireçtaşları, suda çözünür bir mineral olan kalsitten oluşur. Yağmur suyundaki karbondioksit, kalsit ile reaksiyona girerek kireçtaşlarının çözünmesine neden olur.
Oksidasyon, kayaç döngüsünün önemli bir parçasıdır. Bu reaksiyonlar, kayaçların ufalanmasına ve çözünmesine neden olarak yeni toprakların oluşmasına katkıda bulunur.
Redüksiyon
Redüksiyon, kayaçların ayrışmasında önemli bir rol oynayan bir kimyasal reaksiyon türüdür. Bir elementin veya bileşiğin elektron kazanması olayıdır. Kayaçlarda redüksiyon, genellikle organik maddelerin ayrışması veya suyun hidrojen iyonlarının (H+) elektron almasıyla gerçekleşir. Bu reaksiyonlar sonucunda mineral sülfürleri ve karbonatları oluşur. Yükseltgenmenin tersine, elektron kazanma olayıdır. Toprakta gereğinden fazla su bulunduğu zaman, yeter derecede oksijen mevcut olamayacağı için, redüksiyon meydana gelir. Örnek olarak; Ferri oksidin Ferro okside dönüşmesi redüksiyona bir örnek olarak verilebilir.
2Fe2O3 – O2 = 4Fe0
Ferri oksit Ferro oksit
(Hematit)
Redüksiyonun Kayaç Ayrışmasına Etkileri
Redüksiyon, kayaçların ayrışmasına farklı mekanizmalar yoluyla katkıda bulunur:
1. Kimyasal Bileşimde Değişiklik
- Redüksiyon, kayaçların kimyasal bileşimini önemli ölçüde değiştirebilir. Örneğin, demir içeren minerallerin redüklenmesi, kayaçların demir içeriğini azaltabilir.
- Kimyasal bileşimdeki değişiklikler, kayaçların minerallerinin stabilitesini de etkileyebilir. Bu durum, minerallerin ayrışmasına ve yeni minerallerin oluşmasına yol açabilir.
2. Çözünürlük
Redüksiyon sonucu oluşan mineral sülfürleri ve karbonatları, genellikle suda çözünür. Bu çözünürlük, kayaçların ufalanmasına ve çözünmesine yol açabilir.
Redüksiyonun Hızını Etkileyen Faktörler
Redüksiyon reaksiyonlarının hızı, bir dizi faktöre bağlıdır:
- Sıcaklık: Sıcaklık arttıkça reaksiyonların hızı da artar.
- pH: Asidik ortamlar, redüksiyon reaksiyonlarını hızlandırır.
- Organik madde: Organik madde, redüksiyon reaksiyonlarını hızlandırır.
- Minerallerin bileşimi: Farklı mineraller farklı redüksiyon hızlarına sahiptir.
Redüksiyonun Kayaç Ayrışmasına Örnekleri
- Demir içeren minerallerin indirgenmesi: Demir içeren minerallerin indirgenmesi sonucu siderit gibi mineraller oluşur. Bu mineraller suda çözünür ve kayaçların ufalanmasına ve çözünmesine neden olur.
- Kükürt içeren minerallerin indirgenmesi: Kükürt içeren minerallerin indirgenmesi sonucu sülfür bileşikleri oluşur. Bu bileşikler suda çözünerek asit yağmurlarının oluşmasına katkıda bulunur.
- Organik maddelerin ayrışması: Organik maddelerin ayrışması sonucu metan ve diğer gazlar oluşur. Bu gazlar kayaçlarda gözenek oluşturarak ufalanmasına ve çözünmesine neden olur.
Oksidasyon ve Redüksiyon Karşılaştırması
| Özellik | Oksidasyon | Redüksiyon |
|---|---|---|
| Tanım | Elektron kaybı | Elektron kazanımı |
| Etkisi | Kayaçların ufalanması ve çözünmesi | Kayaçların kimyasal bileşiminde değişiklik, ufalanma ve çözünme |
| Hızını etkileyen faktörler | Sıcaklık, nem, minerallerin bileşimi, organik madde | Sıcaklık, pH, organik madde, minerallerin bileşimi |
| Örnekler | Demir paslanması, karbonat kayalarının çözünmesi | Demir indirgenmesi, kükürt indirgenmesi, organik madde ayrışması |
Oksidasyon ve redüksiyon arasındaki önemli farklar şunlardır:
- Oksidasyon, elektron kaybı, redüksiyon ise elektron kazanımı ile gerçekleşir.
- Genellikle oksidasyon kayaçların ufalanmasına ve çözünmesine neden olurken, redüksiyon kayaçların kimyasal bileşimini de değiştirebilir.
- Oksidasyon ve redüksiyon reaksiyonlarının hızını etkileyen faktörler farklıdır.
Her iki reaksiyon türü de kayaç döngüsünün önemli bir parçasıdır ve jeolojik zaman ölçeğinde kayaçların ufalanmasına, çözünmesine ve yeni kayaçların oluşmasına katkıda bulunur.
Diğer Bilgiler
İndirgeme ve yükseltgenme arasındaki fark nedir?
Oksidasyon, bir reaktan reaksiyon sırasında elektron kaybettiğinde meydana gelir. Redüksiyon, bir reaktan reaksiyon sırasında elektron kazandığında meydana gelir. Bu genellikle metaller asitle reaksiyona girdiğinde ortaya çıkar.
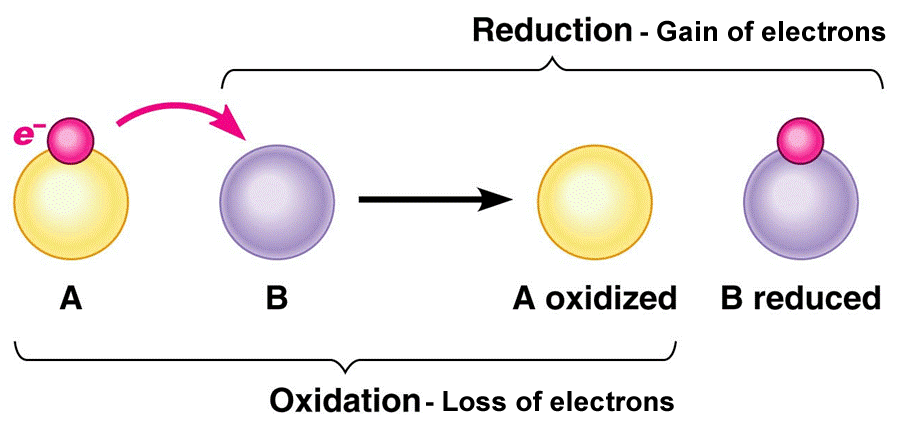
Oksidasyon (yükseltgen), bir molekül, atom veya iyon tarafından reaksiyon sırasında elektron kaybıdır. Oksidasyon oluşan yükseltgenmiş bir molekül, atom veya iyon durumu artar. Tersi süreç, redüksiyon (indirgenme) olarak adlandırılır ve bu, elektron kazancı olduğunda veya bir atomun, molekülün veya iyonun oksidasyon durumu azaldığında meydana gelir.
Redüksiyon (indirgeme), iki kimyasal arasındaki reaksiyona katılan atomlardan birinin elektron kazanmasını içeren kimyasal bir reaksiyondur. Terim, elektron kazanan elementin oksidasyon durumu düştüğü için elektronları kabul eden elementi ifade eder.
Elementlerin Oksidasyon Sayıları Atama Kuralları
Kural 1: Serbest (birleşmemiş) halindeki bir elementin yükseltgenme sayısı sıfırdır. Örneğin, Al (s) veya Zn (s).
Kural 2: Bir tek atomlu (tek atomlu) iyonun yükseltgenme sayısı, iyon üzerindeki yük ile aynıdır.
Kural 3: Nötr bir bileşikteki tüm yükseltgenme sayılarının toplamı sıfırdır.
Oksidasyon sayılarının bulunması
Oksidasyon sayısı serbest elemanının her zaman 0 oksidasyon sayısı tek atomlu bir iyonun iyonunun yükü eşittir. Yükseltgenme sayısı H + 1, ancak -1 az elektronegatif elemanları ile bir araya getirildiğinde de meydana gelir. Yükseltgenme sayısı bileşiklerinde O -2 genellikle, ancak -1 peroksitlerde oluşturur.
Elektron cinsinden indirgeme (redüksiyon)
Oksidasyon, elektron kaybı ve oksijen kazanımı veya hidrojen kaybıdır. İndirgeme, elektron kazancı, oksijen kaybı veya kazanç veya hidrojendir.
Demirin neden sadece 2+ ve 3+ oksidasyon durumu vardır?
Neden demir hem a + 2 hem de a + 3 oksidasyon durumu oluşturabilir? Her ikisi de demir için temel durum olarak, elektron konfigürasyonundan daha iyi kararlılık sağlayacaktır. İyonlar, temel durum olarak atomlarından daha iyi bir kararlılık sağladıkları için oluşur. Ancak ille de mükemmel kararlılık göstermezler. İki demir iyonunun her ikisi de parçacığa daha iyi stabilite sağlar.
So2’deki S’nin yükseltgenme durumu nedir?

Sülfür sahip +4 oksidasyon durumunda, kükürt dioksit, indirgeyici bir ajandır. Bu sebeple S’nin yükseltgenme durumu +4‘tür.
Çinko (Zn) neden yalnızca 2+ iyon oluşturur?
Dördüncü (ve en dıştaki) elektron kabuğunda, Çinko (ZN), kapalı bir n=3 kabuğuna gelmeden önce yalnızca iki elektrona sahiptir. Kapalı kabuk olan elektron değişiklikler de 4s2 kabuğunda olur, böylece çok kararlı. Dördüncü kabuk üzerindeki tüm elektronları kaybetmek olur anlamına gelerek, Zn kaybederek iki yapar, negatif yükler iyon Zn + 2 olur.
Katyon ve anyon nedir?
Pek çok iyonun elektronik konfigürasyonu, periyodik tablodaki kendilerine en yakın soy gazın konfigürasyonudur. Bir anyon, bir veya daha fazla elektron kazanarak negatif bir yük elde eden bir iyondur. Bir katyon, bir pozitif yük kazanma, bir veya daha fazla elektron kaybetmiş bir iyondur.
