Atom: Maddenin en basit ve küçük birimi olup, merkezindeki bir çekirdek etrafında hareket eden elektronlardan oluşur. Çekirdekte artı yüklü protonlar ve buna ilaveten elektrik yükü olmayan nötronlar bulunur. Bir atomda proton sayısı kadar elektron vardır ve bu sonuncuların elektrik yükü eksidir. Böylece atomda artı ve eksi yükler birbirlerini telafi ettiklerinden atom elektrik bakımından nötür durumdadır.
Kütle Numarası (A): Bir atomun çekirdeğindeki proton ve nötronların toplam sayısı olup atomun kütlesini belirler.
Atom Numarası (Z): Atomdaki proton sayısını ve dolayısıyla elektron sayısını belirten sayıdır.
Atom Ağırlığı: Avogadro sayısı kadar atomun gram cinsinden ağırlığıdır. Örneğin 1 tane avogadro sayısı oksijen atomunun ağırlığı 15,9994 gr olup 16 gram olarak kabul edilir.
Molekül Ağırlığı: Avogadro sayısı kadar molekülün gram cinsinden ağırlığıdır. Mol olarak ifade edilir.
İyon: Bir atomun elektron kaybetmesi veya kazanması sonucu artı veya eksi elektrik yüklü durumuna gelmesi halidir.
İzotop Atomlar: Aynı sayıda proton ve dolayısıyla elektron içeren ancak nötron sayısı değişik olan atomlara izotop denir. Örneğin, hidrojenin iki izotopu mevcuttur; döteryumda ayrıca bir, tritiyumda ise iki nötron bulunur. Dolayısıyla bu üç izotopun kütle numaraları sırasıyla 1, 2 ve 3’tür. Uluslararası Kimya Birliği’nin kabulüne göre (1960) atom simgesinin sol yukarısına kütle numarası, sol aşağısına da atom numarası yazılır.
Element: Aynı atom numarasına sahip atomlardan meydana gelen maddelerdir.
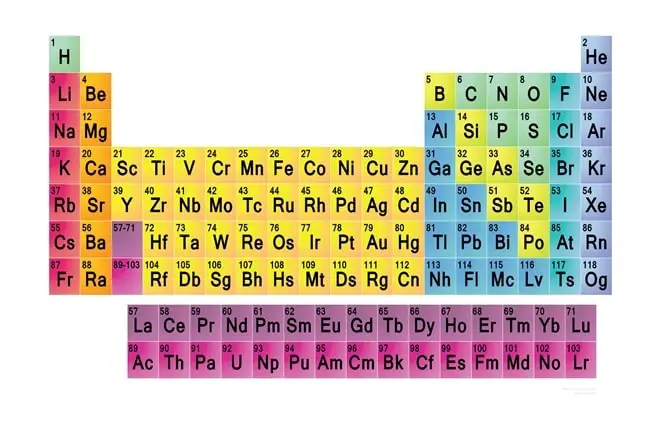
Atom Yapısı ve Periyodik Tablo
Periyodik tabloda yatay sütunlara “periyod” düşey sütunlara da “grup” adı verilmiştir. Tabloda yedi tane peryod bulunmaktadır. Peryodun sol başından sağa doğru ilerledikçe elektron sayısı bir artar. Peryodik tabloda 8 tane baş grup (A), 8 tane de yan grup (B) olmak üzere toplam 16 tane grup vardır. Yan grup elementlerin tümü iki ilk üç baş gruptaki elementler (bor hariç) metaldirler.
Atomların Bağlanma Şekilleri
Atomlar pratik olarak bir küre gibi davranırlar ve bunların yarıçapları 1 Aº civarındadır. Bu yarıçap elementten elemente değiştiği gibi, iyonlaşma derecesine ve atomun yanıbaşındaki atomlarla bağlanma şekline göre de değişir. Atomlar arasında azalan önem derecesine göre başlıca şu dört çeşit bağlanma saptanmıştır:
1-) Heteropolar ve İyonik bağ
2-) Homopolar veya Kovelent bağ (atomik bağ)
3-) Metalik bağ
4-) Van der Waals veya Rezidüel bağ ( soy gazlar arasındaki bağlar)
